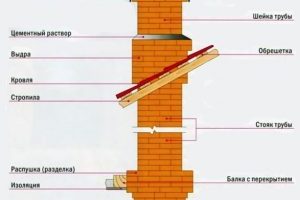
Timberk TCH A1N: инфракрасный обогреватель потолочного монтажа
Инфракрасный обогреватель Timberk TCH A1N предназначен для обогрева помещения площадью до 24 кв.м. Данная модель рассчитана на потолочную установку, предотвращающую контакт с горячей рабочей панелью. Его без опаски можно использовать на территории различных объектов: жилых и нежилых помещений, лоджий и балконов, веранд и террас. Принцип работы Инфракрасный обогреватель Timberk TCH A1N представляет собой прибор…







































![133094928_w640_h640_emali-alkidnye[1]](https://indclimat.ru/wp-content/uploads/2021/01/133094928_w640_h640_emali-alkidnye1-600x400.jpg)
![kak-ochistit-reshetku-vytyazhki[1]](https://indclimat.ru/wp-content/uploads/2021/01/kak-ochistit-reshetku-vytyazhki1-768x512.jpg)